“
国际上最权威的癌症治疗指南——美国国立综合癌症网络指南认为任何癌症患者都可以在临床试验中得到最佳治疗。临床试验是一个获得更好疗效或者最新治疗的机会,尤其对于难治的晚期患者非常宝贵。您的参与将有助于医学对此类疾病的进一步研究和认识,在此,我们为您能够参与科学研究,并为医学的发展做出贡献表示感谢!
渔歌医疗临床招募平台即日起面向全国招募晚期肝癌患者。
参加本试验的患者将获得三甲医院的专家团队对您的病情进行规律的随访及诊疗指导以及第二代抗体疗法无偿治疗。
治疗药物是由齐鲁制药有限公司自主研发的QL1706注射液。信息已在国家“药物临床试验登记与信息公示平台”登记(登记号:CTR20211837)。
关于QL1706注射液
您需要满足下列条件
如果您符合上述条件
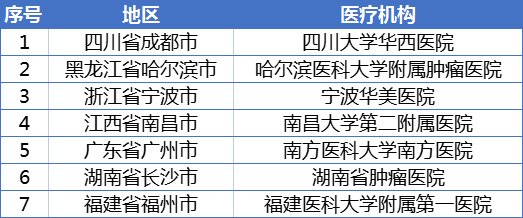
您可在下列三甲医院中选择您的意向医院
如果您已知悉上述情况并有意愿参加该研究,请您点击下方图片进行报名,将由专业的医学团队及三甲医院专家对您的病情进行全面筛选与评估,筛选过程中您可能接到电话来了解您的病情,谢谢您的配合与参与!





