
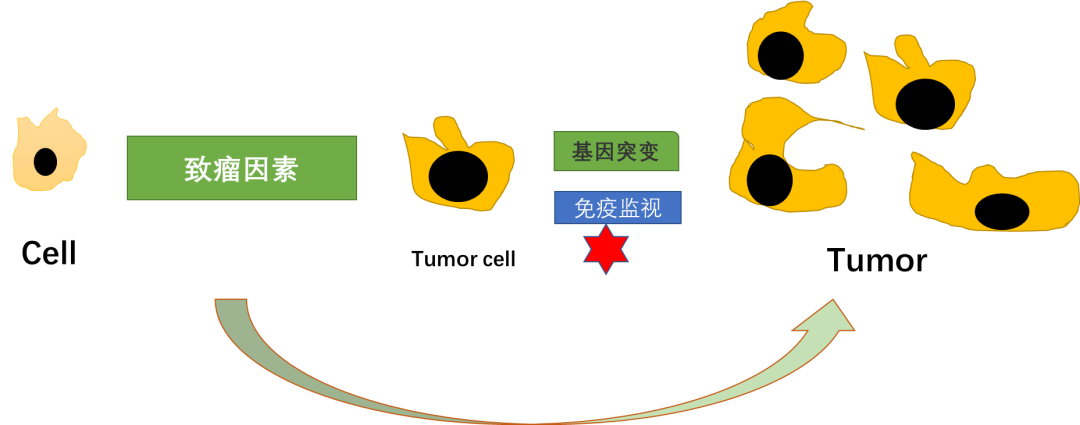
 (右图来源 .sina.com.cn)
(右图来源 .sina.com.cn)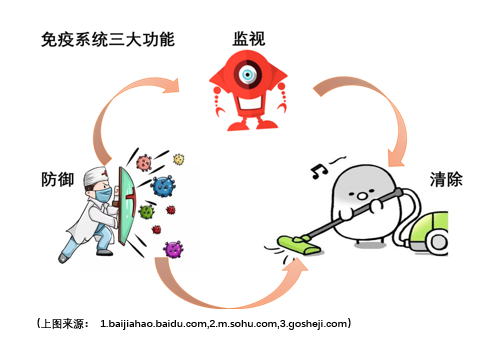
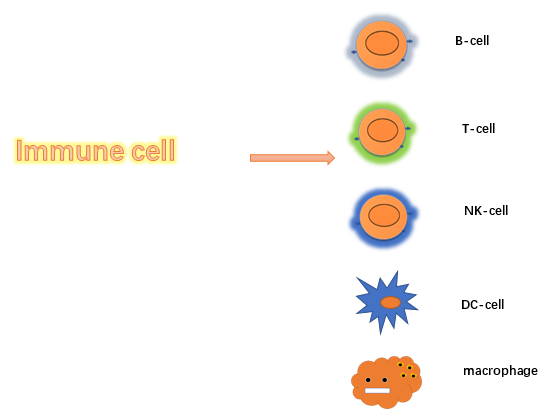
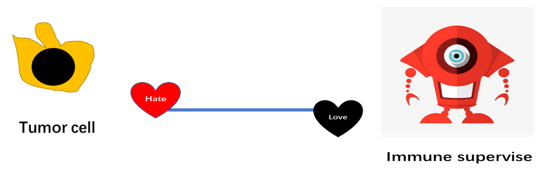
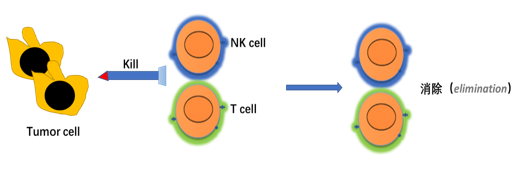
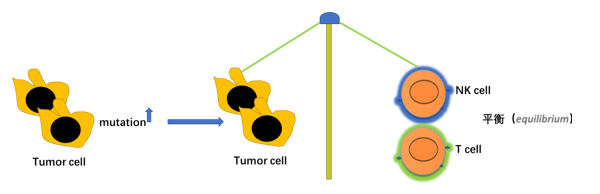
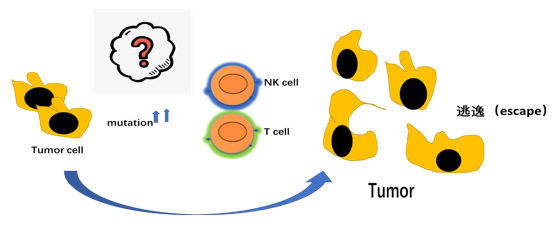
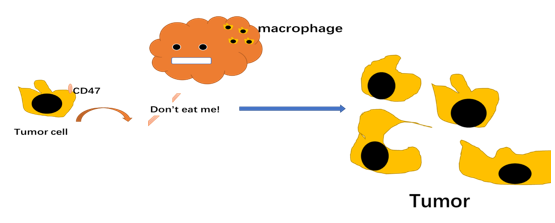
总结
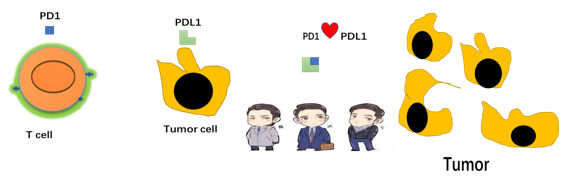
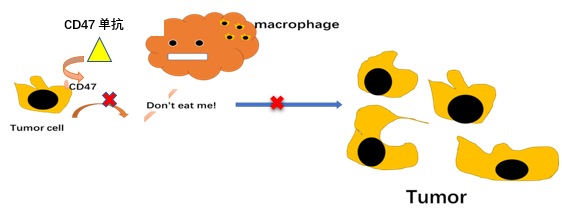
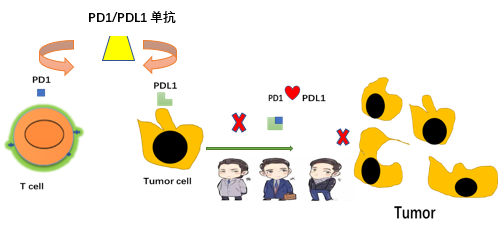
从这些抗肿瘤的方法可以看出,最关键的还是要让我们的免疫系统先识别出肿瘤细胞,才能调动其他的免疫系统细胞一起来抗击肿瘤。而PD-1/PD-L1抑制剂、CTLA-4抗体和靶向CD47 的单抗/融合蛋白药物就是很好的武器。这些药物进入体内之后,就可以阻止肿瘤细胞的免疫逃逸作用,帮助免疫系统擦亮眼睛,准确识别“坏细胞”,从而重新激活肿瘤患者免疫系统的抗肿瘤反应。而且 ,这种治疗方式完全不同于之前的化疗或者是针对基因突变的靶向治疗,疗效显著,适用的人群也更加广泛。
来源:“VIP说 ”微信公众号整理于网络




