KRAS蛋白曾经被认为是一个“不可成药”的靶点 。这种观点主要是因为KRAS蛋白与底物GTP的结合非常强,缺乏明显的药物结合口袋,且KRAS在正常细胞活动也是必需的,这增加了开发靶向药物的难度。然而,近年来的研究已经打破了这个观点,尤其是针对KRAS G12C突变体的小分子抑制剂的开发成功,标志着KRAS“不可成药”的历史已经结束 。
KRAS蛋白曾经被认为是一个“不可成药”的靶点
近年来,KRAS抑制剂的研发是肿瘤治疗领域的一个热点,尤其是针对KRAS G12C和KRAS G12D这两种突变的研究。
● KRAS G12C ●
KRAS G12C是一种在肿瘤治疗领域备受关注的靶点。近年来,针对KRAS G12C的药物研发取得了显著进展。目前,已有两款KRAS G12C抑制剂作为药品上市,还有多种KRAS G12C抑制剂处于研发阶段,例如Garsorasib(D-1553)、JAB-21822、IBI351等。

已获美国FDA批准上市的两款KRAS抑制剂
1. Sotorasib (Lumakras, AMG-510):由安进公司开发,于2021年5月28日获得美国FDA加速批准上市。它用于治疗携带KRAS G12C突变的非小细胞肺癌患者,这些患者至少接受过一种全身性治疗。
2. Adagrasib (Krazati):由Mirati公司开发,于2022年12月13日获得美国FDA加速批准上市。它同样用于治疗至少接受过一种先前全身治疗的KRAS G12C突变非小细胞肺癌患者。
3. IBI351:2023年11月24日,信达生物的KRAS G12C抑制剂IBI351的新药上市申请已获中国国家药品监督管理局(NMPA)药品审评中心(CDE)受理并纳入优先审评。用于治疗至少接受过一种系统性治疗的KRAS G12C突变型的晚期非小细胞肺癌患者。IBI351是中国首个递交NDA的KRAS G12C抑制剂。
4. Garsorasib (格舒瑞昔,D-1553):2023年12月29日,益方生物宣布其KRAS G12C抑制剂Garsorasib的新药上市申请已获得受理。用于既往经一线系统治疗后疾病进展或不可耐受的、并且经检测确认存在KRAS G12C突变的局部晚期或转移性非小细胞肺癌的治疗。
5. Glecirasib (JAB-21822):2024年5月6日,加科思药业宣布其KRAS G12C抑制剂Glecirasib的新药上市申请已正式提交,并且已获得中国国家药品监督管理局(NMPA)的优先评审。用于治疗二线及以上治疗带有KRAS G12C突变的晚期或转移性非小细胞肺癌患者。
尽管已有药物上市,但它们的客观反应率(ORR)并未超过50%,表明疗效仍有提升空间。目前,研究者正在探索新制剂和联合治疗策略以提高疗效。新的研发方向包括针对KRAS GTP结合状态的抑制剂,如RMC-6291和RMC-6236。联合治疗是提高KRAS G12C抑制剂疗效的另一策略。例如,Sotorasib与曲美替尼联合治疗以及与不同剂量阿法替尼的联合治疗方案已显示出较高的疾病控制率。
根据弗若斯特沙利文的数据,全球KRAS G12C突变阳性癌症的发病人数预计将持续增长,预示着未来对KRAS G12C抑制剂的需求可能会增加。KRAS G12C药物研发正朝着提高疗效、克服耐药以及探索新的治疗策略等方向发展。随着更多临床试验结果的公布,未来可能会有更多创新药物和治疗方案出现,为癌症治疗提供更多选择。
● KRAS G12D ●
KRAS G12D是实体瘤中最常见的KRAS突变亚型,尤其在胰腺癌、结直肠癌和肺腺癌中。由于全球尚无KRAS G12D抑制剂上市,存在巨大的未满足临床需求,这推动了KRAS G12D抑制剂的研发热潮。然而,由于KRAS G12D缺乏共价结合位点,开发针对性的抑制剂面临挑战。以下是KRAS G12D抑制剂的研发现状:
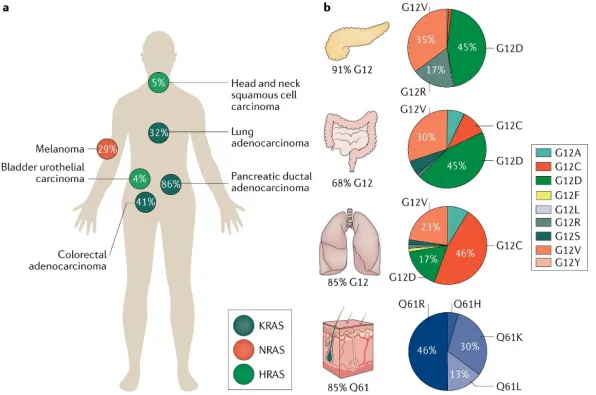
Nat Rev Drug Discov. 2020 Dec;19(12):902.
1. MRTX1133:由Mirati Therapeutics公司开发的MRTX1133是一种非共价抑制剂,能够同时与处于失活状态和激活状态的KRAS G12D突变体结合。它在临床前研究中显示出对KRAS G12D突变的肿瘤具有显著的抑制作用。
2. HRS-4642:2022年8月2日,恒瑞医药发布公告,公司收到国家药监局核准签发关于HRS-4642注射液的《药物临床试验批准通知书》。恒瑞医药HRS-4642为国内首个获批临床的KRAS G12D抑制剂。由恒瑞医药开发的HRS-4642是一种高效、长效、特异性的KRAS G12D抑制剂,能够特异性结合KRAS G12D,进而抑制MEK、ERK蛋白的磷酸化,发挥抗肿瘤作用。
3. GFH375:2024年6月19日,劲方医药宣布自主研发的KRAS G12D(ON/OFF)抑制剂GFH375临床试验申请获得国家药品监督管理局批准,同意公司针对KRAS G12D 基因突变的晚期实体瘤患者开展开放标签、多中心I/II期临床试验。
4. AST2169:艾力斯医药自主研发的具有全球知识产权的KRAS G12D选择性抑制剂,2024年3月13日,中国国家药监局药品审评中心(CDE)公示,AST2169获批进入临床阶段,用于评估其在KRAS G12D突变晚期实体瘤患者中的安全性、耐受性、药代动力学及初步疗效。
5. QLC1101:2024年4月8日,齐鲁制药开发的1类化药新药QLC1101胶囊,获得了中国国家药监局药品审评中心(CDE)的临床试验默示许可,拟用于携带KRAS G12D突变的晚期实体瘤患者。
由于全球尚无KRAS G12D抑制剂上市,存在巨大的未满足临床需求,这些在研药物大多仍处于早期临床阶段。随着对KRAS G12D结构和功能认识的深入,以及药物设计和筛选技术的进步,KRAS G12D抑制剂的研发前景看好,有望为携带KRAS G12D突变的肿瘤患者提供新的治疗选择。
渔歌临床招募平台癌症患者招募,全国各地有中心,涵盖前沿靶向药、抗体偶联药物、PD-1/PD-L1免疫疗法、CAR-T细胞疗法、双特异性抗体疗法、免疫联合靶向疗法……




